Podľa spôsobu spojenia aminokyseliny a cukru možno cukrový peptid rozdeliť do štyroch kategórií: O glykozylácia, C a N glykozylácia, rosné sacharifikácia a GPI (glykofosfatidlyinozitol) spojenie.
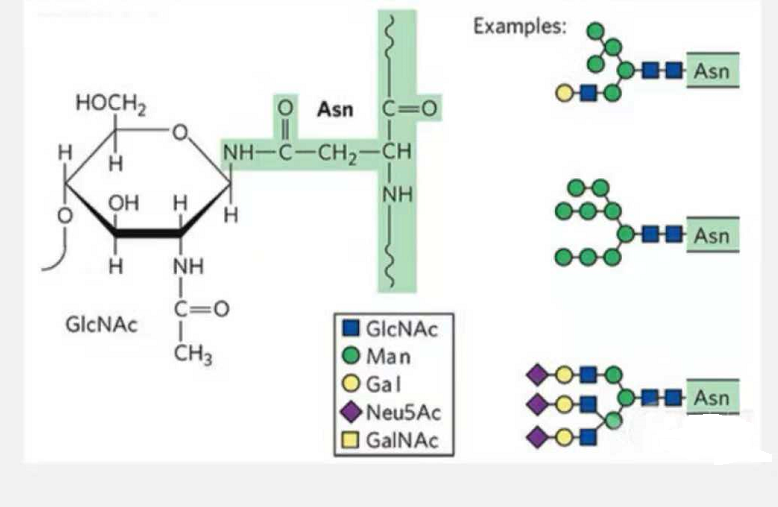
1. N-glykozylačné glykopeptidy sú zložené z N-acetamid glukózy na redukujúcom konci glykánového reťazca (Glc-Nac) pripojenej k atómu N na amidovej skupine bočného reťazca niektorých Asn v peptidovom reťazci a Asn schopné spojiť glykánový reťazec sa musia nachádzať v AsN-X-Ser/Thr (X! = P) v motíve tvorenom zvyškami.Cukor je N-acetylglukózamín.
N-glykozyláciou modifikovaný štruktúrny glykopeptid
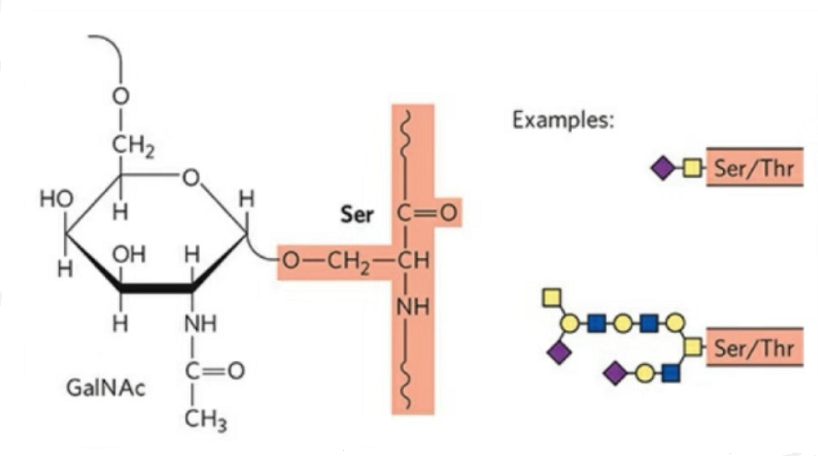
2. Štruktúra O-glykozylácie je jednoduchšia ako N-glykozylácia.Tento glykopeptid je vo všeobecnosti kratší ako glykán, ale má viac typov ako N-glykozylácia.Ser a Thr môžu byť všeobecne glykozylované v peptidovom reťazci.Okrem toho existujú glykopeptidy zdobené tyrozínovou, hydroxylovou a hydroxyprolínovou glykozyláciou.Pozícia väzby je hydroxylový kyslíkový atóm na bočnom reťazci zvyšku.Spojené cukry sú galaktóza alebo N-acetylgalaktozamín (Gal&GalNAc) alebo glukóza/glukózamín (Glc/GlcNAc), manóza/manozamín (Man/ManNAc) atď.
O-glykozylácia modifikuje štruktúru
3. Glykopeptidová O-GlcNAC glykozylácia ((N-acetylcysteín (NAC)) (glcnAcN-acetylglukózamín/acetylglukózamín)
Jediná glykozylácia N-acetylglukózamínu (GlcNAc) spája proteíny O-GlcNAc s hydroxylovým atómom kyslíka serínového alebo treonínového zvyšku proteínu.O-GlcNA glykozylácia je O-GlcNAc monosacharidový ornament bez glykánovej extenzie;Podobne ako fosforylácia peptidov, O-GlcNAc glykozylácia glykopeptidov je tiež procesom dynamickej dekorácie proteínov.Abnormálne zdobenie O-GlcNAc môže spôsobiť rôzne ochorenia, ako je cukrovka, kardiovaskulárne ochorenia, nádory, Alzheimerova choroba a tak ďalej.
Glykozylačné body glykopeptidov
Základné štruktúry polypeptidových a cukrových reťazcov sú spojené s proteínovými reťazcami kovalentnými väzbami a miesta spájajúce cukrové reťazce sa nazývajú glykozylačné miesta.Pretože neexistuje templát, ktorý by sledoval biosyntézu glykopeptidových cukrových reťazcov, rôzne cukrové reťazce budú pripojené k rovnakému glykozylačnému miestu, čo vedie k takzvanej mikroskopickej nehomogenite.
Glykozylácia glykopeptidov
1. Vplyv glykozylácie glykopeptidu na účinnosť terapie terapeutickými proteínmi
V prípade terapeuticko-terapeutických proteínov glykozylácia ovplyvňuje aj polčas rozpadu a cielenie proteínových liečiv in vivo
2. Glykozylácia rozpustného glykopeptidu a proteínov
Štúdie ukázali, že cukrové reťazce na povrchu proteínov môžu zlepšiť molekulárnu rozpustnosť proteínov
3. Glykopeptidová glykozylácia a proteínová imunogenicita
Na jednej strane môžu cukrové reťazce na povrchu proteínov vyvolať špecifické imunitné reakcie.Na druhej strane cukrové reťazce môžu pokryť určité povrchy na povrchu proteínu a znížiť jeho imunogenicitu
4. Glykopeptidová glykozylácia, ktorá zvyšuje stabilitu proteínu
Glykozylácia môže zvýšiť stabilitu proteínov voči rôznym podmienkam denaturácie (ako sú denaturačné činidlá, teplo atď.) a zabrániť agregácii proteínov.Súčasne môžu cukrové reťazce na povrchu proteínov pokryť aj niektoré body proteolytickej degradácie proteínových molekúl, čím sa zvyšuje odolnosť proteínov voči proteinázam.
5. Glykopeptidová glykozylácia, ktorá ovplyvňuje biologickú aktivitu proteínových molekúl
Zmena glykozylácie proteínov môže tiež umožniť molekulám proteínov vytvárať nové biologické aktivity
Čas uverejnenia: august-03-2023