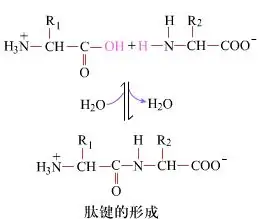
Na povrchu je tvorba peptidových väzieb za vzniku dipeptidov jednoduchým chemickým procesom.To znamená, že dve aminokyselinové zložky sú spojené peptidovou väzbou, amidovou väzbou, pričom sú dehydratované.
Tvorba peptidovej väzby je aktivácia aminokyseliny za miernych reakčných podmienok.(A) karboxylová skupina, druhá aminokyselina (B) Nukleofilne aktivovaná karboxylová skupina potom tvorí dipeptid (AB)."Ak karboxylová zložka (A) nie je chránená, nemožno kontrolovať tvorbu peptidovej väzby."Vedľajšie produkty, ako sú lineárne a cyklické peptidy, môžu byť zmiešané s cieľovými zlúčeninami AB.Preto musia byť všetky funkčné skupiny, ktoré sa nezúčastňujú na tvorbe peptidovej väzby, počas syntézy peptidov dočasne reverzibilným spôsobom chránené.
Takže syntéza peptidov - tvorba každej peptidovej väzby - zahŕňa tri kroky agregácie.
Prvým krokom je príprava niektorých aminokyselín, ktoré potrebujú ochranu, a zwitteriónová štruktúra aminokyselín už neexistuje.
Druhým krokom je dvojkroková reakcia na vytvorenie peptidových väzieb, pri ktorej sa najprv aktivuje karboxylová skupina N-chránenej aminokyseliny na aktívny medziprodukt a potom sa vytvorí peptidová väzba.Táto spojená reakcia môže prebiehať buď ako jednokroková reakcia alebo ako dve po sebe nasledujúce reakcie.
Tretím krokom je selektívne odstránenie alebo úplné odstránenie ochrannej základne.Hoci k úplnému odstráneniu môže dôjsť až po zostavení všetkých peptidových reťazcov, na pokračovanie syntézy peptidov je tiež potrebné selektívne odstránenie ochranných skupín.
Pretože 10 aminokyselín (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec a Cys) obsahuje funkčné skupiny postranných reťazcov, ktoré vyžadujú selektívnu ochranu, čím je syntéza peptidov komplikovanejšia.Základy dočasnej a polotrvalej ochrany sa musia rozlišovať z dôvodu rôznych požiadaviek na selektivitu.Dočasné ochranné skupiny sa používajú v ďalšom kroku na vyjadrenie dočasnej ochrany aminokyselín alebo karboxylových funkčných skupín.Semipermanentné ochranné skupiny sa odstraňujú bez zásahu do už vytvorených peptidových väzieb alebo postranných reťazcov aminokyselín, niekedy počas syntézy.
"V ideálnom prípade by aktivácia karboxylovej zložky a následná tvorba peptidových väzieb (kopulačné reakcie) mala byť rýchla, bez tvorby racemických alebo vedľajších produktov a na dosiahnutie vysokých výťažkov by sa mali použiť molárne reaktanty."Žiaľ, žiadna z metód chemickej väzby nespĺňa tieto požiadavky a len málo z nich je vhodných na praktickú syntézu.
Počas syntézy peptidov sú funkčné skupiny zapojené do rôznych reakcií zvyčajne spojené s manuálnym centrom, glycín je jedinou výnimkou a existuje potenciálne riziko rotácie.
Posledným krokom v cykle syntézy peptidov je odstránenie všetkých ochranných skupín.Selektívne odstránenie ochranných skupín je dôležité pre predlžovanie peptidového reťazca okrem požiadavky na úplné odstránenie ochrany pri syntéze dipeptidov.Syntetické stratégie by mali byť starostlivo naplánované.V závislosti od strategickej voľby môže N selektívne odstrániť a-amino alebo karboxylové chrániace skupiny.Pojem „stratégia“ označuje postupnosť kondenzačných reakcií jednotlivých aminokyselín.Vo všeobecnosti je rozdiel medzi postupnou syntézou a kondenzáciou fragmentov.Syntéza peptidov (tiež známa ako „konvenčná syntéza“) prebieha v roztoku.Vo väčšine prípadov je možné postupné predlžovanie peptidového reťazca syntetizovať len použitím peptidového reťazca na syntézu kratších fragmentov.Aby sa syntetizovali dlhšie peptidy, cieľové molekuly sa musia segmentovať na vhodné fragmenty a určiť, že môžu minimalizovať stupeň diferenciácie na C-konci.Po postupnom zostavení jednotlivých fragmentov dôjde k spojeniu cieľovej zlúčeniny.Stratégia syntézy peptidov zahŕňa výber najlepšieho a najvhodnejšieho ochranného fragmentu a stratégia syntézy peptidov zahŕňa výber najvhodnejšej kombinácie ochranných báz a najlepšieho spôsobu konjugácie fragmentov.
Čas odoslania: 19. júla 2023